Alchenele
Alchenele
Alchenele sunt hidrocarburi nesaturate si aciclice care conțin o legătură dublă între doi atomi de carbon având formula moleculară generală CnH2n. Legătura dublă dintre cei doi atomi de carbon este alcătuită dintr-o legătură de tip σ și o legătură de tip π.
Etilena, cea mai simplă alchenă
Denumire
Denumirea alchenelor se face înlocuind sufixul „-an” (din denumirea alcanului cu număr identic de atomi de carbon) prin sufixul „-enă„.
n=2 CH2= CH2 etena
n=3 CH3-CH= CH2 propena
Structura moleculara
C = C
Obtinerea alchenelor
a) Deshidratarea alcoolilor, prin încălzire cu acid sulfuric la 150 – 200°C.
R-CH2-CH2-OH (alcool) –> R-CH=CH2 (alchena) + H2O
b) Dehidrohalogenarea derivaţilor halogenaţi: La încălzire cu baze tari, în soluţii alcoolice, derivaţii halogenaţi elimină hidracid cu formarea unei alchene:
R-CH2-CH2X (derivat halogenat) –> R-CH=CH2 + HX , unde X poate fi F, Cl, Br sau I.
c) Cracarea alcanilor: În acest proces, larg aplicat în industrie, se formează cantităţi mari de alchene.
Proprietati fizice
Alchenele pot fi gazoase, lichide sau solide, după numărul atomilor de carbon din moleculă. Alchenele de la C2 la C5 sunt gaze, cele de la C5 la C18 sunt lichide, iar alchenele superioare sunt solide.
Punctele de fierbere şi de topire cresc o dată cu masa moleculară, dar sunt mai mici decât la alcanii corespunzători. Au densitatea mai mică decât apa, sunt insolubile în apă, dar solubile în solvenţi organici. Sunt incolore şi fără miros.
Proprietati chimice
Datorită prezenţei dublei legături, reactivitatea chimică a alchenelor este mai mare decât a alcanilor.
I) Reacţii de adiţie
a) Adiţia hidrogenului:
R─CH═CH2 (alchenă) + H2 –> R─CH2─CH3 (alcan)
Procesul de hidrogenare la temperaturi cuprinse între 80 – 200°C şi până la 200 atm. Drept catalizatori se folosesc ca Ni, Pt, Pd, etc.
b) Adiţia halogenilor la alchene conduce la derivaţi di-halogenaţi vicinali (halogenul se leagă la atomi de carbon vecini).
c) Adiţia de hidracizi la alchene duce la obţinere de derivaţi mono-halogenaţi:
Atunci când alchena este simetrică, adiţia decurge fără condiţii, ca în exemplul de mai sus. Dacă alchena este asimetrică, atunci se aplică regula lui Markovnikov (atomul de halogen se fixează la atomul cel mai sărac în hidrogen).
Exemplu: R-CH=CH2 (alchenă asimetrică) + HCl –> R-CHCl-CH3 (derivat halogenat)
d) Adiţia apei la alchene duce la formarea alcoolilor (dacă avem o alchenă nesimetrică, se aplică regula lui Markovnikov). Reacţia este prezentată în imaginea de mai jos.
II) Reacţia de oxidare
Oxidarea cu permanganat de potasiu în mediu de acid sulfuric determină ruperea dublei legături cu obţinere de acizi sau cetone, în funcţie de structura alchenei supuse oxidării:
III) Reacţia de polimerizare
Prin polimerizare se înţelege procesul chimic prin care un mare număr de molecule identice, ale unor compuşi nesaturaţi, se leagă între ele, formând o moleculă unică (macromoleculă). Schematic, procesul de polimerizare se reprezintă:
nA → ─[A]n─
Exemplu: nCH2═CH2 → ─ [CH2─CH2]n ─ (polietenă)
Indicele n, numit grad de polimerizare, arată numărul de molecule de etenă care alcătuiesc lanţul macromolecular. Substanţa A este monomer, iar produsul final este polimerul.
Izomeria
– apare de la C4 si se formeaza ca urmare a modificarii pozitiei dublei legaturi in catena
b) de catena:
– apare tot de la C4 si se formeaza prin ramificarea catenelor alchenelor liniare
c) de functiune:
– cu cicloalcanii – deoarece cele 2 clase de compusi au aceeasi formulă moleculară generală (CnH2n);
e) spatiala:
– Pentru alchene e posibilă izomeria spațială deoarece legătura dublă face inflexibilă la rotire atomii de C uniți prin această legătură dubla.
Domenii de utilizare:
•Prelucrarea cauciucului;
•tipografie;
•solventi;
•benzine sintetice;
•agenti frigorifici;
•combustibili;
•mase plastice;
•medicina si farmacie etc.




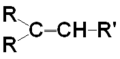





Lasă un comentariu